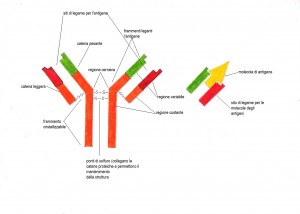
Gli anticorpi o immunoglobuline (Ig) sono delle glicoproteine presenti nel sangue e in altri fluidi biologici dell’uomo e dell’animale. Questi anticorpi sono molecole sintetizzate in risposta alla presenza di un antigene e che, a sua volta sintetizzati, si combinano con quell’antigene. Tutte le molecole immunoglobuliniche hanno una struttura formata da quattro catene polipeptidiche due leggere e due pesanti connesse tra di loro medianti ponti di solfuro. Ogni catena leggera (L) è costituita circa da 220 ammminoacidi, ogni catena pesante (H) è invece formata da 440 amminoacidi ed è diversa per ciascuna classe o sottoclasse di immunoglobuline. Sia le catene pesanti sia le catene leggere sono costituite da due distinte regioni; le regioni variabili e le regioni costanti. Le regioni costanti (CL e CH) possiedono delle sequenze amminoacidiche che non variano molto negli anticorpi della medesima classe o sottoclasse. Le regioni variabili (VL e VH) presentano differenti sequenze amminoacidiche nei diversi anticorpi. Le quattro catene sono legate fra loro in modo tale da formare una “Y” flessibile con una regione cerniera, La porzione assiale della Y è detta frammento cristalizzabile (FC), e contiene il sito di legame dell’anticorpo alle cellule dotate di recettore specifico. I due bracci aperti della Y contengono due frammenti leganti l’antigene (FAB) che si legano ai determinanti antigenici complementari. L’ FC è costituito solitamente da regioni costanti, mentre i due FAB contengono sia sequenze costanti che sequenze variabili.
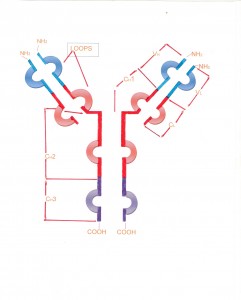
Oltre ai legami di solfuro intercatenari (che connettono tra loro le catene pesanti e quelle leggere ) esistono anche legami di solfuro intracatenari che formano dei Loops: ogni anello insieme con circa 25 amminoacidi su ciascun lato costituisce un dominio. Le catene pesanti possono essere di due tipi : kappa (K) e Lampda (λ) esse possono essere distinte tra di loro per la diversa sequenza amminoacidica della porzione carbossi-terminale della loro catena. Nell’uomo, la porzione carbossi-terminale di tutte le catene K è identica, per cui tale regione viene anche detta dominio costante (CL). Per quanto riguarda le catene lambda, ci sono invece 4 sequenze possibili carbossi-terminali, che definiscono i sottotipi λ1, λ2, λ3 e λ4, con le corrispondenti 4 regioni costanti (Cλ):Cλ1,Cλ2,Cλ3 e Cλ4.All’interno della porzione variabile delle catene leggere si sono delle regioni ipervariabili. Nelle catene pesanti,il dominio mmino-terminale( VH) ha uno spettro di variabilità simile a quello delle corrispondenti regioni variabili delle catene leggere e tale dominio contiene 4 regioni ipervariabili. I restanti domini delle catene pesanti, facenti parte della porzione costante CH,vengono detti CH1,CH2,CH3.
FUNZIONE DELLE IMMUNOGLOBULINE
Tutte le molecole immunoglobuliniche hanno una doppia funzione, il Fab è specializzato per il riconoscimento e per il legame con l’antigene, mentre il Fc interagisce con le cellule immunocompetenti o con le prime frazioni del complemento (C), Il legame tra un anticorpo e l’antigene specifico di solito non determina la distruzione di quest’ultimo.ma piuttosto serve a “marcare” l’antigene per il successivo attacco da parte del sistema immunitario: ad esempio: i batteri ricoperti di anticorpi, vengono fagocitati in maniera più efficace dai neutrofili e dai macrofagi. Questa particolare proprietà degli anticorpi è detta opsonizzazione.
Classi immunoglobuline
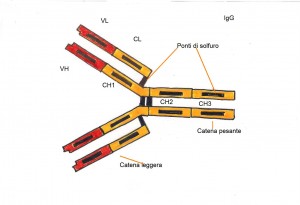
Le IgG sono le immunoglobuline più rilevanti a livello sierico rappresentano il 70-75% del totale delle immunoglobuline, esse hanno un ruolo importante nella difesa contro i batteri e virus,inoltre possono attivare il complemento mediante la via classica. Le IgG rappresentano l’unica classe immunoglobulinica in grado di attraversare la placenta e di conferire immunità passiva naturale al neonato. Ci sono 4 sottoclassi di IgG (IgG1, IgG2.IgG3 e IgG4) che variano tra di loro per i ponti di solfuro e per la sequenza del segmento costante.
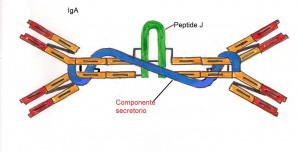
Le IgA rappresentano il 15% del totale delle immunoglobuline più rivelanti nelle secrezioni. Nel siero alcune IgA hanno la peculiare caratteristica di essere in relazione alle difese immunitarie associate alle mucose. Durante il trasporto dal tessuto linfoide associato alle mucose (MALT) alla superficie mucosale, esse acquisiscono una catena proteica denominata componente secretoria. Le IgA secretorie (sIgA) . Rappresentano le immunoglobuline di prima linea del sistema immunitario: esse si riscontrano nel canale gastroenterico, nelle alte e basse vie respiratorie. nell’apparato urogenitale, ma anche nella saliva, nelle lacrime e nel latte.
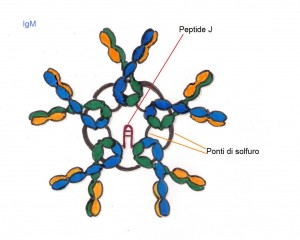
IgM rappresentano circa il 10% delle immunoglobuline (circolanti e non ); sono pentameri in quanto sono costituiti da 5 molecole anticorpali unite tra di loro da ponti di solfuro e da un peptide di congiunzione detto peptide J. Queste sono le prime immunoglobuline che si formano durante l’ontogenesi dei linfociti B e le prime immunoglobuline a essere secrete in corso di una risposta immunologica primaria, data la loro grossa dimensione non sono in grado di attraversare la placenta. Le IgM sono in grado di provocare l’agglutinazione dei batteri, di attivare il complemento mediante la via classica.
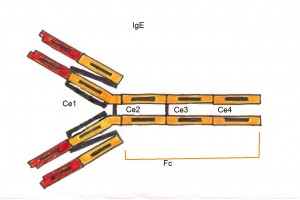
- IgE: sono presenti nel siero in concentrazione bassissima e sono responsabili della risposta allergica (asma, orticaria, raffreddore da fieno..). Aumentano notevolmente durante le infezioni da parassiti.
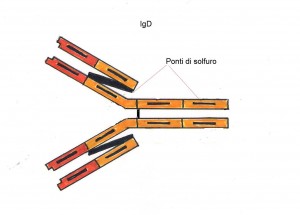
Le IgD sono riscontrabili nel siero solo in tracce, hanno una struttura monomerica simile a quella delle IgG, non fissano il complemento e non attraversano la placenta, sono però numerose sulla superficie dei linfociti B, dove servano a interagire con l’antigene e a dare il segnale iniziale per la produzione iniziale delle altre classi di anticorpi.