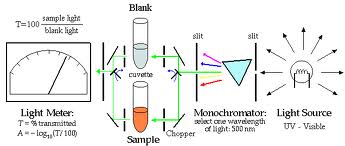
La sorgente luminosa è costutiuta da una lampada che emette luce bianca. Questa viene convogliata verso il monocromatore che scompone questa nelle diverse componenti monocromatiche, il selezionatore fa passare attraverso la cuvetta solo i raggi luminosi di una lunghezza d’onda precisa di colore complementare sul circolo di Ostwald a quello della soluzione da analizzare. La soluzione in cuvetta assorbe la radiazione in quantità direttamente proporzionale alla concentrazione della soluzione ed allo spessore della cuvetta stessa. Il fotorivelatore rileva l’energia luminosa emergente dalla cuvetta e genera un segnale elettrico proporzionale all’intensità di tale luce. Tale segnale è amplificato e trasmesso al galvanometro che né da una misura. Con opportune tecniche elettroniche il segnale viene trasformato in unità di assorbanza o concentrazione, quindi valutato.
In pratica mantenendo costante lo spessore della cuvetta e variando la concentrazione della soluzione avremo per ogni concentrazione il corrispettivo valore di attenuazione o estinzione dell’energia luminosa segnalata dal galvanometro, perciò mettendo su un sistema cartesiano sull’asse delle ascisse le misure galvanometriche e sull’asse delle ordinate le relativa concentrazioni otterremo quello che potremo chiamare curva di taratura di una misurazione fotometrica.
Vi è quindi una proporzionalità diretta tra la quantità di luce assorbita che chiameremo E, la concentrazione della soluzione che chiameremo c e lo spessore della cuvetta che chiameremo s; questo rapporto di proporzionalità rappresenta la legge di Lambert e Beer:
Quando una radiazione monocromatica attraversa una soluzione l’assorbanza è direttamente proporzionale alla concentrazione e allo spessore della cuvetta:
E = csK
dove K, detto coefficiente di estinzione, è una costante che caratterizza ogni singola sostanza capace di assorbire. Se s è uguale a 1 cm e K è una costante potremo semplificare la formula in:
E = c
cioè l’assorbanza della soluzione è proporzionale alla concentrazione della soluzione.
Questa è la legge fondamentale della fotometria che è la metodologia di misura che utilizzando valutazioni della quantità di colore consente valutazioni della concentrazione delle sostanze in soluzione tramite attenuazione dell’intensità luminosa di un raggio monocromatico incidente.
I problemi che presenta la chimica clinica nelle determinazioni colorimetriche dei principali metaboliti del plasma sono due:
1) Il plasma è un mestruo complesso come fare a dosare singole sostanze senza l’interferenza di altre?
2) Alcune sostanze sono contenute in piccole quantità come fare per ottenere dosaggi sensibili con costi contenuti?
Nelle risoluzioni del primo punto si potrebbero utilizzare soluzioni complesse capaci di separare il metabolita che vogliamo dosare dal mestruo plasmatico; ma ciò comporterebbe costi in tempo e materiale nonché scarse ripetitività del metodo.
Per tale motivo si preferisce far reagire il componente che intendiamo dosare in maniera che esso si coniughi specificamente con una molecola reattiva e che da questa copula si sviluppi un colore altrettanto specifico le cui variazioni di intensità riflettano variazioni di concentrazione del metabolita da dosare.
Una condizione alternativa invece è quella di far reagire il metabolita con catalizzatori biologici specifici detti enzimi.
Questi attaccano le molecole da dosare e producono sostanze reattive in quantità proporzionale a quella del metabolita posto a reagire.
Queste sostanze prodotte dall’attività enzimatica e dette componenti intermedie di reazione vengono poi fatte reagire con particolari substrati sviluppando colore di intensità pari alla loro concentrazione e quindi alla concentrazione del metabolita.
Questi secondi metodi per la loro sensibilità e specificità consentono di risolvere il primo e il secondo punto su riportato.
I metaboliti d’interesse biologico presenti nel sangue sono numerosi e sono genericamente classificati in: proteine, substrati cristalloidi ed elettroliti.
Tra le proteine ricordiamo l’albumina, le proteine dell’infiammazione, della coagulazione, alcuni ormoni.
Tra i substrati cristalloidi: il glucosio, acido urico, bilirubina, colesterolo ecc.
Tra gli elettroliti: il sodio, potassio, ferro, rame ecc